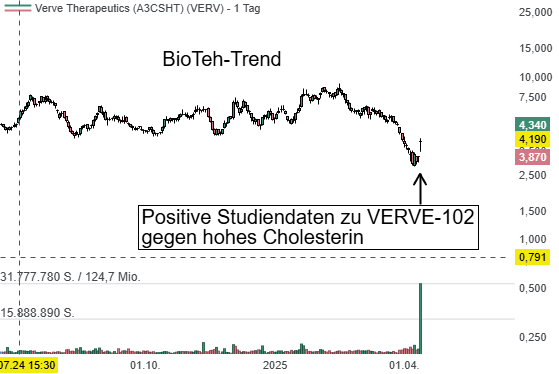
Verve Therapeutics hat einen bedeutenden Fortschritt in der Entwicklung seiner Gen-Editing-Therapie VERVE-102 erzielt. In einer frühen klinischen Studie der Phase 1b zur Behandlung von familiär bedingtem hohem Cholesterin (HeFH) sowie frühzeitiger koronarer Herzkrankheit konnte bei Patienten eine deutliche Senkung des LDL-Cholesterinspiegels erreicht werden. Besonders hervorzuheben ist die Wirksamkeit bei einer Dosierung von 0,6 mg/kg: Hier fiel der LDL-C-Wert im Durchschnitt um 53 %, bei einzelnen Personen sogar um bis zu 69 %. Parallel dazu wurden auch die Konzentrationen des Cholesterin-regulierenden Proteins PCSK9 signifikant reduziert.
Die Therapie, die einmalig als Infusion verabreicht wird, soll durch gezieltes Ausschalten des PCSK9-Gens in der Leber dauerhaft wirken – ein innovativer Ansatz mit potenziell lebenslanger Wirkung. Laut Unternehmensangaben wurde VERVE-102 von den Patienten sehr gut vertragen, ohne schwere Nebenwirkungen oder sicherheitsrelevante Auffälligkeiten. Die laufende Studie wird nun mit einer weiteren Dosierungsgruppe (0,7 mg/kg) in Ländern wie dem Vereinigten Königreich, Kanada, Australien, Israel und Neuseeland fortgesetzt. Die finalen Ergebnisse werden für die zweite Jahreshälfte 2025 erwartet. Eine Phase-2-Studie ist für Ende des Jahres geplant, vorbehaltlich behördlicher Zustimmung. Die US-amerikanische FDA hat VERVE-102 bereits den begehrten "Fast Track"-Status verliehen, was die Zulassungsprozesse beschleunigen könnte.
Die Therapie, die einmalig als Infusion verabreicht wird, soll durch gezieltes Ausschalten des PCSK9-Gens in der Leber dauerhaft wirken – ein innovativer Ansatz mit potenziell lebenslanger Wirkung. Laut Unternehmensangaben wurde VERVE-102 von den Patienten sehr gut vertragen, ohne schwere Nebenwirkungen oder sicherheitsrelevante Auffälligkeiten. Die laufende Studie wird nun mit einer weiteren Dosierungsgruppe (0,7 mg/kg) in Ländern wie dem Vereinigten Königreich, Kanada, Australien, Israel und Neuseeland fortgesetzt. Die finalen Ergebnisse werden für die zweite Jahreshälfte 2025 erwartet. Eine Phase-2-Studie ist für Ende des Jahres geplant, vorbehaltlich behördlicher Zustimmung. Die US-amerikanische FDA hat VERVE-102 bereits den begehrten "Fast Track"-Status verliehen, was die Zulassungsprozesse beschleunigen könnte.








 & Profi-Tools von
& Profi-Tools von